Коллеги, в своей рутинной практике в каком объеме исследуете материал радикальной простатэктомии? (в комментариях прошу аргументировать свой выбор при желании).
Anonymous Poll
55%
Всю предстательную железу тотально (даже если получается over 100 кассет)
45%
Частично (главное - целиком исследовать псевдокапсулу)
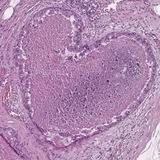
Интрадуктальная карцинома (часть 1).
Интрадуктальная карцинома простаты представляет собой опухолевую эпителиальную пролиферацию с вовлечением предсуществующих расширенных протоковых и ацинарных структур, характеризующуюся архитектурной и клеточной атипией, превышающей таковую при простатической интраэпителиальной неоплазии высокой степени. Обычно ассоциирована с инвазивным раком простаты высокой степени злокачественности, но в редких случаях может представлять собой предраковое поражение.
Перестройка ERG присутствует в большинстве случаев интрадуктальной карциномы, а потеря экспрессии PTEN выявляется примерно в 85% случаев, причем последнее редко наблюдается при PIN HG.
Схема патогенеза интрадуктального рака предстательной железы (источник: Zong, Yang et al (2020). Intraductal Carcinoma of the Prostate: Pathogenesis and Molecular Perspectives. European Urology Focus, (), S2405456920302911)
Интрадуктальная карцинома простаты представляет собой опухолевую эпителиальную пролиферацию с вовлечением предсуществующих расширенных протоковых и ацинарных структур, характеризующуюся архитектурной и клеточной атипией, превышающей таковую при простатической интраэпителиальной неоплазии высокой степени. Обычно ассоциирована с инвазивным раком простаты высокой степени злокачественности, но в редких случаях может представлять собой предраковое поражение.
Перестройка ERG присутствует в большинстве случаев интрадуктальной карциномы, а потеря экспрессии PTEN выявляется примерно в 85% случаев, причем последнее редко наблюдается при PIN HG.
Схема патогенеза интрадуктального рака предстательной железы (источник: Zong, Yang et al (2020). Intraductal Carcinoma of the Prostate: Pathogenesis and Molecular Perspectives. European Urology Focus, (), S2405456920302911)
🔥14❤1👍1
Интрадуктальная карцинома (часть 2).
Прогноз
В материале радикальной простатэктомии наличие интрадуктальной карциномы коррелирует:
❗️с более высокой степенью злокачественности инвазивного рака,
❗️с большим объемом опухоли,
❗️с большей вероятностью экстрапростатического распространения,
❗️с инвазией в семенные пузырьки,
❗️метастазированием в тазовые лимфатические узлы.
Также связано с биохимическим рецидивом, худшими показателями выживаемости без прогрессирования и смертности от рака после радикальной простатэктомии.
В материале биопсии предстательной железы наличие интрадуктальной карциномы обычно ассоциировано:
❗️с инвазивным раком предстательной железы высокой степени злокачественности,
❗️с большим объемом опухоли,
❗️с неблагоприятными результатами радикальной простатэктомии и клиническим исходом.
Интрадуктальная карцинома ассоциирован с ранним биохимическим рецидивом, опухоль-специфической выживаемостью, выживаемостью у пациентов с отдаленными метастазами на момент поступления и неблагоприятными результатами лучевой терапии при раке простаты среднего и высокого риска (возникновение метастазов).
Прогноз
В материале радикальной простатэктомии наличие интрадуктальной карциномы коррелирует:
❗️с более высокой степенью злокачественности инвазивного рака,
❗️с большим объемом опухоли,
❗️с большей вероятностью экстрапростатического распространения,
❗️с инвазией в семенные пузырьки,
❗️метастазированием в тазовые лимфатические узлы.
Также связано с биохимическим рецидивом, худшими показателями выживаемости без прогрессирования и смертности от рака после радикальной простатэктомии.
В материале биопсии предстательной железы наличие интрадуктальной карциномы обычно ассоциировано:
❗️с инвазивным раком предстательной железы высокой степени злокачественности,
❗️с большим объемом опухоли,
❗️с неблагоприятными результатами радикальной простатэктомии и клиническим исходом.
Интрадуктальная карцинома ассоциирован с ранним биохимическим рецидивом, опухоль-специфической выживаемостью, выживаемостью у пациентов с отдаленными метастазами на момент поступления и неблагоприятными результатами лучевой терапии при раке простаты среднего и высокого риска (возникновение метастазов).
🔥15👍3❤2
Интрадуктальная карцинома (часть 3).
Микроскопическая картина:
🔬Поражение предсуществующих расширенных ацинусов и протоков с сохранным или частично сохранным слоем базальных клеток.
🔬Плотное криброзное или солидное строение.
🔬Рыхлое криброзное или микропапиллярное строение с выраженным ядерным плеоморфизмом или комедо-некрозами.
🔬Плотные криброзные структуры – преобладание клеточного компонента над просветами (менее 50% площади представлено просветами).
🔬Выраженный ядерный плеоморфизм (6-кратное увеличение размера ядра по сравнению с нормальными ядрами).
🔬В некоторых случаях криброзное поражение частично поражает железу.
Дополнительные окраски, ИГХ
🔬базальные клетки: высокомолекулярные цитокератины – CKHMW / 34BE12 (5 фото), CK5/6, р63.
🔬ацинарный эпителий: AMACR/p504s, PSA, PSAP.
🔬высокие значения индекса мечения Ki67.
🔬чаще наблюдается потеря экспрессии PTEN.
Микроскопическая картина:
🔬Поражение предсуществующих расширенных ацинусов и протоков с сохранным или частично сохранным слоем базальных клеток.
🔬Плотное криброзное или солидное строение.
🔬Рыхлое криброзное или микропапиллярное строение с выраженным ядерным плеоморфизмом или комедо-некрозами.
🔬Плотные криброзные структуры – преобладание клеточного компонента над просветами (менее 50% площади представлено просветами).
🔬Выраженный ядерный плеоморфизм (6-кратное увеличение размера ядра по сравнению с нормальными ядрами).
🔬В некоторых случаях криброзное поражение частично поражает железу.
Дополнительные окраски, ИГХ
🔬базальные клетки: высокомолекулярные цитокератины – CKHMW / 34BE12 (5 фото), CK5/6, р63.
🔬ацинарный эпителий: AMACR/p504s, PSA, PSAP.
🔬высокие значения индекса мечения Ki67.
🔬чаще наблюдается потеря экспрессии PTEN.
🔥12👍3❤2
Интрадуктальная карцинома (часть 4).
Дифференциальная диагностика
1. Простатическая интраэпителиальная неоплазия высокой степени:
🔬Пучковое, микропапиллярное и уплощенное строение;
🔬Отсутствие выраженного ядерного плеоморфизма;
🔬Отсутствие некроза;
🔬Отсутствие выраженной митотической активности.
Ацинарная аденокарцинома (градация 4 и 5):
🔬Отсутствие слоя базальных клеток;
2. Уротелиальный рак in situ в протоках предстательной железы:
🔬Солидное строение, отсутствие криброзного строения;
🔬Экспрессия CK7, GATA3, p63, Uroplakin III; отсутствие экспрессии PSA.
3. Инвазивный уротелиальный рак:
🔬Отсутствие слоя базальных клеток;
🔬Солидное строение, отсутствие криброзного строения;
🔬Более выраженный клеточный и ядерный плеоморфизм;
🔬Более частые митозы;
🔬Экспрессия CK7, GATA3, p63, Uroplakin III; отсутствие экспрессии PSA.
4. Протоковый рак:
🔬Отсутствие слоя базальных клеток;
🔬Псевдостратифицированный эпителий, образованный столбчатыми клетками с вытянутыми гиперхромными ядрами;
🔬Инфильтративный рост.
5. Атипическая внутрипротоковая пролиферация:
🔬Рыхлое криброзное строение с сохранным слоем базальных клеток и ядерным плеоморфизмом, не соответствующим таковому для внутрипротокового рака.
6. Железы центральной зоны:
🔬Криброзное/микропапиллярное строение желез, вид «римских мостиков»;
🔬Сосочки имеют фиброваскулярный остов;
🔬Отсутствие цитологической атипии, с мелкими ядрышками;
🔬Иногда встречается цитоплазматический «золотистый» липофусцин;
🔬Центральное/базальное расположение.
Дифференциальная диагностика
1. Простатическая интраэпителиальная неоплазия высокой степени:
🔬Пучковое, микропапиллярное и уплощенное строение;
🔬Отсутствие выраженного ядерного плеоморфизма;
🔬Отсутствие некроза;
🔬Отсутствие выраженной митотической активности.
Ацинарная аденокарцинома (градация 4 и 5):
🔬Отсутствие слоя базальных клеток;
2. Уротелиальный рак in situ в протоках предстательной железы:
🔬Солидное строение, отсутствие криброзного строения;
🔬Экспрессия CK7, GATA3, p63, Uroplakin III; отсутствие экспрессии PSA.
3. Инвазивный уротелиальный рак:
🔬Отсутствие слоя базальных клеток;
🔬Солидное строение, отсутствие криброзного строения;
🔬Более выраженный клеточный и ядерный плеоморфизм;
🔬Более частые митозы;
🔬Экспрессия CK7, GATA3, p63, Uroplakin III; отсутствие экспрессии PSA.
4. Протоковый рак:
🔬Отсутствие слоя базальных клеток;
🔬Псевдостратифицированный эпителий, образованный столбчатыми клетками с вытянутыми гиперхромными ядрами;
🔬Инфильтративный рост.
5. Атипическая внутрипротоковая пролиферация:
🔬Рыхлое криброзное строение с сохранным слоем базальных клеток и ядерным плеоморфизмом, не соответствующим таковому для внутрипротокового рака.
6. Железы центральной зоны:
🔬Криброзное/микропапиллярное строение желез, вид «римских мостиков»;
🔬Сосочки имеют фиброваскулярный остов;
🔬Отсутствие цитологической атипии, с мелкими ядрышками;
🔬Иногда встречается цитоплазматический «золотистый» липофусцин;
🔬Центральное/базальное расположение.
🔥15❤5👍2
Интрадуктальная карцинома (часть 5).
Коллеги, продолжаем говорить об интрадукальной карциноме - действительно, тема обширная 💯. И противоречивая. Разное отношение к ней и у двух ведущих мировых уропатологических сообществ - GUPS и ISUP 👨🔬🧑🔬. Даю ссылки на две основные статьи, с которыми однозначно стоит ознакомиться: https://journals.lww.com/ajsp/fulltext/2020/08000/the_2019_international_society_of_urological.1.aspx и https://meridian.allenpress.com/aplm/article/145/4/461/442303/The-2019-Genitourinary-Pathology-Society-GUPS
Коллеги, продолжаем говорить об интрадукальной карциноме - действительно, тема обширная 💯. И противоречивая. Разное отношение к ней и у двух ведущих мировых уропатологических сообществ - GUPS и ISUP 👨🔬🧑🔬. Даю ссылки на две основные статьи, с которыми однозначно стоит ознакомиться: https://journals.lww.com/ajsp/fulltext/2020/08000/the_2019_international_society_of_urological.1.aspx и https://meridian.allenpress.com/aplm/article/145/4/461/442303/The-2019-Genitourinary-Pathology-Society-GUPS
🔥11❤1👍1
Коллеги, и сразу же опрос: а Вы включаете интрадуктальную карциному в сумму баллов по Глисону? Как всегда, буду рад активным обсуждениям в комментариях
Anonymous Poll
26%
Включаю
59%
Не включаю
15%
Зависит от настроения, ситуации и тд
Коллеги, как Вы знаете, врач-патологоанатом - это не только микроскоп, вырезка и вскрытия💯. Нас всех характеризует довольно широкий кругозор и спектр интересов помимо медицины🎬🎨🎤🎷🎳. И хочется узнать лучше друг друга, какие мы в повседневной жизни. И, возможно, найти единомышленников не только в области диагностического мышления, но и в других сферах. Поэтому, с этого воскресенья начинаю "Опрос выходного дня", который, надеюсь, с Вашей помощью станет традиционным (каждое воскресенье)🙏. Говорим сегодня о литературе📚 (не медицинской😜). Напишите, пожалуйста, в комментарии свои 3-5 любимых книг ⬇️⬇️⬇️
❤11
Рубрика "Журнальный клуб" 🧐📚
На просторах Pubmed обнаружил интересную статью, посвященную клинико-патологическому и иммуногистохимическому анализу связанного с лечением нейроэндокринного рака предстательной железы.
⬇️⬇️⬇️
Среди 231 случаев кастрационно-резистентного рака предстательной железы (КРРПЖ), 94 (40.7%) случаев оказались связанным с лечением нейроэндокринным раком предстательной железы (T-NEPC). T-NEPC с большей вероятностью характеризовались иммунонегативностью к AR (30.9%) и PSA (47.9%) чем КРРПЖ (8.8% и 17.5%, соответственно). Анализ Каплана-Мейера показал, что пациенты с T-NEPC (медиана общей выживаемости [ОВ]: 17,6 месяцев, 95% ДИ: 15.3–19.9 месяцев) имели значительно худшую выживаемость по сравнению с пациентами с обычным КРРПЖ (медиана общей выживаемости: 23,6 месяцев, 95% ДИ: 21.3-25.9 months, log-rank P = 0.001), особенно в случаях метастазов (медиана ОВ: 15,7 месяцев, 95% ДИ: 13,3-18,0 месяцев) и пациентов с компонентом мелкоклеточного рака (медиана ОВ: 9,7 месяцев, 95% ДИ: 8,2–11,2 мес). Пациенты с аденокарциномой предстательной железы с диффузной нейроэндокринной дифференцировкой (медиана ОВ: 18,8 месяцев, 95% ДИ: 15,3–22,3 месяцев) характеризовались худшим исходом, чем пациенты с обычным КРРПЖ ( P = 0,027), в то время как не было обнаружено статистически значимых изменений в случае аденокарциномы с очаговой нейроэндокринной дифференцировкой (медиана ОВ: 22,9 мес, 95% ДИ: 18,1–27,7 мес, P = 0,136). В нескорректированной модели повышенный риск общей смертности наблюдался у пациентов с T-NEPC с негативным PSA (ОР = 2,86, 95% ДИ = 1,39–6,73). Среди 476 случаев нейроэндокринного рака предстательной железы в базе данных SEER с 2004 по 2017 год мы наблюдали более высокий риск общей смертности у пациентов в возрасте 65 лет и старше (ОР = 1,35, 95% ДИ = 1,08–1,69), пациентов с ПСА ≤ 2,5 нг/мл (ОР = 1,90, 95%ДИ = 1,44–2,52), пациентов с ПСА 2,6–4,0 нг/мл (ОР = 2,03, 95%ДИ = 1,38–2,99), с опухолью IV стадии (ОР = 2,13, 95%ДИ = 1,47) –3,08) и пациентов других рас (кроме европеоидной и негроидной) (ОР = 1,85, 95% ДИ = 1,17–2,94) в общей кагорте нейроэндокринного рака предстательной железы с поправкой на искажающие факторы. Подобные соотношения рисков наблюдались в группе чистой нейроэндокринной карциномы предстательной железы, в то время как в группе аденокарциномы простаты с нейроэндокринной дифференцировкой не было значимых результатов.
Заключение
T-NEPC был связан с неблагоприятным прогнозом; PSA-негативные T-NEPC и с уровнем ПСА в сыворотке ≤ 4 нг/мл имели худший прогноз. Урологи и патологи должны осознавать важность повторной биопсии при КРРПЖ, чтобы избежать задержку в диагностике и лечении.
👉Ссылка на полную версию статьи: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7882702/
На просторах Pubmed обнаружил интересную статью, посвященную клинико-патологическому и иммуногистохимическому анализу связанного с лечением нейроэндокринного рака предстательной железы.
⬇️⬇️⬇️
Среди 231 случаев кастрационно-резистентного рака предстательной железы (КРРПЖ), 94 (40.7%) случаев оказались связанным с лечением нейроэндокринным раком предстательной железы (T-NEPC). T-NEPC с большей вероятностью характеризовались иммунонегативностью к AR (30.9%) и PSA (47.9%) чем КРРПЖ (8.8% и 17.5%, соответственно). Анализ Каплана-Мейера показал, что пациенты с T-NEPC (медиана общей выживаемости [ОВ]: 17,6 месяцев, 95% ДИ: 15.3–19.9 месяцев) имели значительно худшую выживаемость по сравнению с пациентами с обычным КРРПЖ (медиана общей выживаемости: 23,6 месяцев, 95% ДИ: 21.3-25.9 months, log-rank P = 0.001), особенно в случаях метастазов (медиана ОВ: 15,7 месяцев, 95% ДИ: 13,3-18,0 месяцев) и пациентов с компонентом мелкоклеточного рака (медиана ОВ: 9,7 месяцев, 95% ДИ: 8,2–11,2 мес). Пациенты с аденокарциномой предстательной железы с диффузной нейроэндокринной дифференцировкой (медиана ОВ: 18,8 месяцев, 95% ДИ: 15,3–22,3 месяцев) характеризовались худшим исходом, чем пациенты с обычным КРРПЖ ( P = 0,027), в то время как не было обнаружено статистически значимых изменений в случае аденокарциномы с очаговой нейроэндокринной дифференцировкой (медиана ОВ: 22,9 мес, 95% ДИ: 18,1–27,7 мес, P = 0,136). В нескорректированной модели повышенный риск общей смертности наблюдался у пациентов с T-NEPC с негативным PSA (ОР = 2,86, 95% ДИ = 1,39–6,73). Среди 476 случаев нейроэндокринного рака предстательной железы в базе данных SEER с 2004 по 2017 год мы наблюдали более высокий риск общей смертности у пациентов в возрасте 65 лет и старше (ОР = 1,35, 95% ДИ = 1,08–1,69), пациентов с ПСА ≤ 2,5 нг/мл (ОР = 1,90, 95%ДИ = 1,44–2,52), пациентов с ПСА 2,6–4,0 нг/мл (ОР = 2,03, 95%ДИ = 1,38–2,99), с опухолью IV стадии (ОР = 2,13, 95%ДИ = 1,47) –3,08) и пациентов других рас (кроме европеоидной и негроидной) (ОР = 1,85, 95% ДИ = 1,17–2,94) в общей кагорте нейроэндокринного рака предстательной железы с поправкой на искажающие факторы. Подобные соотношения рисков наблюдались в группе чистой нейроэндокринной карциномы предстательной железы, в то время как в группе аденокарциномы простаты с нейроэндокринной дифференцировкой не было значимых результатов.
Заключение
T-NEPC был связан с неблагоприятным прогнозом; PSA-негативные T-NEPC и с уровнем ПСА в сыворотке ≤ 4 нг/мл имели худший прогноз. Урологи и патологи должны осознавать важность повторной биопсии при КРРПЖ, чтобы избежать задержку в диагностике и лечении.
👉Ссылка на полную версию статьи: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7882702/
PubMed Central (PMC)
Treatment-Emergent Neuroendocrine Prostate Cancer: A Clinicopathological and Immunohistochemical Analysis of 94 Cases
This study aimed to evaluate the pathological characteristics, immunophenotype, and prognosis of treatment-emergent neuroendocrine prostate cancer (T-NEPC).We collected 231 repeated biopsy specimens of castration-resistant prostate cancer (CRPC) cases ...
👌2❤1
Доброе утро, коллеги ☀️🌻 Из Г.Лавкрафта наверняка получился бы отличный патоморфолог с его "неописуемыми монстрами"... А если серьезно, то "опухоль неуточненного гистогенеза и неясного злокачественного потенциала" - это первая мысль, которая нередко возникает у меня при первом взгляде на некоторые опухоли, в т.ч. некоторые мягкотканные 🤭🤫 А у вас бывает такое? 😉 А вообще, те, кто здорово разбирается в мягкотканных опухолях, лимфомах и прочих таких локализациях - супер круты! 🤘💪🧠 А что касается вчерашнего случая для разбора - ИГХ-препараты и правильный диагноз
⬇️⬇️⬇️⬇️
Думаю, что результаты ИГХ-исследования говорят сами за себя - это действительно гастроинтестинальная стромальная опухоль. Коллеги, спасибо за активное обсуждение кейса, за аргументированные идеи!🔥 Была у меня мысль в сторону липосаркомы, учитывая локализацию (малый таз), но поражение прямой кишки навело на мысль о ГИСТе, и захотелось в первую очередь исключить его.
⬇️⬇️⬇️⬇️
Думаю, что результаты ИГХ-исследования говорят сами за себя - это действительно гастроинтестинальная стромальная опухоль. Коллеги, спасибо за активное обсуждение кейса, за аргументированные идеи!🔥 Была у меня мысль в сторону липосаркомы, учитывая локализацию (малый таз), но поражение прямой кишки навело на мысль о ГИСТе, и захотелось в первую очередь исключить его.
❤7🔥2
Интересное наблюдение 🔬🧐
Явление, которое может ввести в заблуждение и стать причиной диагностической ошибки - это доброкачественное пери- и интраневральное расположение клеток Лейдига (на микрофотографиях - в области придатка яичка и семенного канатика). У пациента - смешанная герминогенная опухоль яичка.
Похожий случай описан в одной из статей: https://academic.oup.com/ajcp/article/149/suppl_1/S36/4801374
Явление, которое может ввести в заблуждение и стать причиной диагностической ошибки - это доброкачественное пери- и интраневральное расположение клеток Лейдига (на микрофотографиях - в области придатка яичка и семенного канатика). У пациента - смешанная герминогенная опухоль яичка.
Похожий случай описан в одной из статей: https://academic.oup.com/ajcp/article/149/suppl_1/S36/4801374
🔥15❤1
Коллеги, надеюсь, не сильно устали? 💪 У меня для Вас кейс на вечер 🧠🔬Мужчина, 37 лет, опухоль правого яичка. ЛГ - 5,25 МЕ/л, б-ХГЧ - 0,72 МЕ/л, АФП - 0,77 МЕ\мл. С удовольствием жду Ваши идеи, возможную ИГХ-панель (если нужно) 💪😉
🔥10
СПЕРМАТОЦИТАРНАЯ ОПУХОЛЬ – НЕСКОЛЬКО ФАКТОВ❗️
👉Герминогенная опухоль, происходящая из зародышевых клеток постпубертатного типа, в которой опухолевые клетки напоминают сперматогонии или ранние первичные сперматоциты.
⚡️ICD-0: 9063/3
🔬Диффузные скопления клеток без явных фиброзных перегородок и лимфоцитарных инфильтратов.
🔬Многоузловые поражения демонстрируют прослойки рыхлой фиброваскулярной ткани, разделяющие узлы (с лимфоцитарной инфильтрацией или без них) и без остатков тестикулярной паренхимы между узлами.
❗️Отличительная черта – клеточная популяция из клеток 3-х разных размеров:
🔎Клетки малого размера (6-8 микрон): круглые темные ядра; узкий ободок эозинофильной цитоплазмы; напоминают лимфоциты.
🔎Клетки среднего размера (15-20 микрон): круглые ядра с зернистым или нитевидным хроматином; обычно нет явных ядрышек, хотя могут присутствовать; плотная эозинофильная или амфофильная цитоплазма без гликогена; плохо очерченные цитоплазматические мембраны; рядом с отечными участками можно найти более светлые клетки с отчетливыми мембранами.
🔎Крупные клетки (50-150 мкм): 1 или более ядер с признаками клеток среднего размера; эозинофильная цитоплазма с признаками клеток среднего размера.
‼️Часто встречается внутриканальцевый рост, но GCNIS отсутствует.
🎨ИГХ «+»: CD117, SALL4, OCT2 (белки, которые обычно идентифицируют в сперматогониях и ранних сперматоцитах).
🎨ИГХ «-»: OCT3/4, PLAP, AFP, β-hCG, CD30, ЕМА, АЕ1/АЕ3.
👉Герминогенная опухоль, происходящая из зародышевых клеток постпубертатного типа, в которой опухолевые клетки напоминают сперматогонии или ранние первичные сперматоциты.
⚡️ICD-0: 9063/3
🔬Диффузные скопления клеток без явных фиброзных перегородок и лимфоцитарных инфильтратов.
🔬Многоузловые поражения демонстрируют прослойки рыхлой фиброваскулярной ткани, разделяющие узлы (с лимфоцитарной инфильтрацией или без них) и без остатков тестикулярной паренхимы между узлами.
❗️Отличительная черта – клеточная популяция из клеток 3-х разных размеров:
🔎Клетки малого размера (6-8 микрон): круглые темные ядра; узкий ободок эозинофильной цитоплазмы; напоминают лимфоциты.
🔎Клетки среднего размера (15-20 микрон): круглые ядра с зернистым или нитевидным хроматином; обычно нет явных ядрышек, хотя могут присутствовать; плотная эозинофильная или амфофильная цитоплазма без гликогена; плохо очерченные цитоплазматические мембраны; рядом с отечными участками можно найти более светлые клетки с отчетливыми мембранами.
🔎Крупные клетки (50-150 мкм): 1 или более ядер с признаками клеток среднего размера; эозинофильная цитоплазма с признаками клеток среднего размера.
‼️Часто встречается внутриканальцевый рост, но GCNIS отсутствует.
🎨ИГХ «+»: CD117, SALL4, OCT2 (белки, которые обычно идентифицируют в сперматогониях и ранних сперматоцитах).
🎨ИГХ «-»: OCT3/4, PLAP, AFP, β-hCG, CD30, ЕМА, АЕ1/АЕ3.
🔥17
А теперь по поводу дифференциальной диагностики с другими опухолями🆚. В данном посте хотел бы акцентировать Ваше внимание на семиноме, так как именно с ней чаще всего приходится дифференцировать сперматоцитарную опухоль . Несмотря на их схожесть (на первый взгляд), у обеих существуют принципиальные черты, отличающие их друг от друга🔬. Основные такие отличия отражены в таблице 📝
🔥15👍4
Коллеги, вот пример коварного внутриканальцевого распространения сперматоцитарной опухоли, которое можно принять за GCNIS. По результатам ИГХ - характерная для сперматоцитарной опухоли диффузная экспрессия CD117 и отсутствие экспрессия OCT3/4.
🔥7😱1